A punto de comenzar noviembre, nos encontramos en una etapa clave durante esta prolongada pandemia por COVID-19 que está esperando el desarrollo científico de una solución que la termine. En camino a ello, este mes se esperan los primeros resultados en fase clínica 3 de un puñado de candidatas avanzadas en tiempo récord, de las más de 160 registradas por la Organización Mundial de la Salud.
Una de ellas es la vacuna rusa Sputnik V, registrada el 11 de agosto y también criticada por haber visto luz verde en Rusia, cuando todavía no estaban los resultados de la etapa clínica avanzada, la nombrada fase 3. Pero el martes último, las autoridades rusas se adelantaron a muchas otras candidatas y pidieron ante las autoridades de la OMS la preclasificación de su vacuna contra el nuevo coronavirus SARS-CoV-2, un paso clave para obtener la aprobación mundial para su distribución y utilización.
Otro espaldarazo recibido a la vacuna desarrollada en el centro de investigaciones de Moscú, Gamaleia, en colaboración con el ministerio de Defensa ruso, fueron las declaraciones a Infobae del doctor Nadey Hakim, vicepresidente de la Academia Internacional de Ciencias Médicas, que analizó en profundidad a Sputnik V, una de las firmes candidatas contra COVID-19.
“La vacuna es una herramienta importante para combatir el COVID-19 y salvar al mundo. Este enfoque debe basarse en las mejores tecnologías disponibles a nivel mundial. Los países deberían tener una cartera de diversas vacunas y la rusa Sputnik V, ciertamente, debería estar entre ellas. He revisado los datos presentados y divulgados y las publicaciones correspondientes en The Lancet, una de las principales revistas médicas internacionales. Allí, los resultados de los ensayos clínicos de la vacuna Sputnik V han demostrado su eficacia. Obtuvo resultados positivos de los ensayos clínicos de fase I y II. Y actualmente, están en curso los ensayos de fase III a gran escala y se espera que los primeros resultados se publiquen en una revista médica en noviembre”, expresó de manera enfática Hakim, que también es profesor de cirugía de trasplante en el Imperial College de Londres.
Como se publicó en The Lancet, el 100% de los adultos sanos participantes en los ensayos clínicos de Fase I-II de Sputnik V demostraron una fuerte respuesta inmune frente al SARS-CoV-2. Se llevarán a cabo más investigaciones para validar los resultados de la Fase I-II en el estudio, en curso, de Fase III que se está llevando a cabo en Rusia y en varios otros países. El ensayo clínico en curso de Fase III de la Sputnik V tendrá una duración de seis meses y contará con la participación de más de 40.000 voluntarios. El gran número de participantes en el estudio se compara favorablemente con los ensayos de Fase III de otras vacunas en estudio frente al COVID-19.
Creada de forma artificial, sin ningún elemento del coronavirus en su composición, se presenta en forma liofilizada, es decir, como un polvo que se mezcla con un excipiente para disolverlo y luego administrarlo por vía intramuscular.
El fármaco utiliza una tecnología de adenovirus humano de dos vectores diferentes, Ad5 y Ad26, para una primera y una segunda inyección. Sin embargo, Sputnik V no contiene adenovirus humanos vivos, sino vectores adenovirales humanos que no son capaces de multiplicarse y son completamente seguros para la salud. Se basa en una plataforma de vacuna de dos vectores ya existente, desarrollada en 2015 para tratar el ébola, que superó todas las fases de los ensayos clínicos y fue utilizada para derrotar la epidemia de esa enfermedad en África en 2017. Otras empresas están utilizando también plataformas basadas en vectores adenovirales humanos para sus vacunas contra el COVID-19, como Johnson & Johnson, que usa solo el vector Ad26, y la china CanSino, que emplea únicamente el Ad5.
“Lo más importante para cualquier vacuna es la prueba de su seguridad y su eficacia. La vacuna Sputnik V emplea una plataforma basada en vectores adenovirales humanos probada en más de 250 ensayos clínicos llevados a cabo desde 1953. Es alentador que más países de América del Sur estén negociando acuerdos para producir la vacuna a nivel local así como también lo están haciendo China, India, Brasil, Corea y Turquía. Estos países podrán exportar la vacuna a los países vecinos y más allá”, se entusiamó Hakim.
Y agregó: “Sin duda que la cooperación entre los países y los productores será bienvenida. La necesitamos para aunar esfuerzos. Creo que con suerte volveremos a la normalidad en marzo de 2021 pero, aun así, la vacuna será útil y estará posiblemente disponible para todo el planeta”. Rusia es el cuarto país más afectado por la pandemia con más de 1,5 millones de casos y más de 26.500 fallecidos. Moscú y su región son el principal foco de la enfermedad.
¿Quién desarrolló concretamente la vacuna Sputnik V?
Sputnik V (Gam-COVID-Vac) es una vacuna COVID-19 desarrollada por el Centro Nacional de Investigación en Epidemiología y Microbiología, que lleva el nombre del Académico Honorario N. F. Gamaleya, del Ministerio de Salud de la Federación Rusa. El Centro de Investigación Gamaleya es un instituto de investigación médica ruso con sede en Moscú, pionero en la investigación en microbiología y vacunas. Fundado en 1891, es uno de los institutos de investigación líderes en su campo a nivel mundial. El centro posee una colección única de virus y tiene su propia línea de producción de vacunas.
¿Cuál fue el papel del Fondo Ruso de Inversión Directa en el desarrollo de la Sputnik V?
El Fondo Ruso de Inversión Directa (RDIF), el fondo soberano de inversión de Rusia, ha trabajado intensamente para apoyar la lucha contra el COVID-19. Trabajando en conjunto con inversores institucionales, el RDIF ha seleccionado y financiado uno de los sistemas más prometedores de testeo, así como medicamentos y vacunas contra el COVID-19.
¿De dónde obtuvo la vacuna su nombre Sputnik V?
La vacuna fue nombrada en referencia al primer satélite del mundo, Sputnik-1, que dio origen al llamado “momento Sputnik”, que mostró a la comunidad global nuevas posibilidades tecnológicas. Al igual que el Sputnik-1, la Sputnik V se está desarrollando para brindar nuevas posibilidades globales, para la salud de las personas y de las economías mundiales.
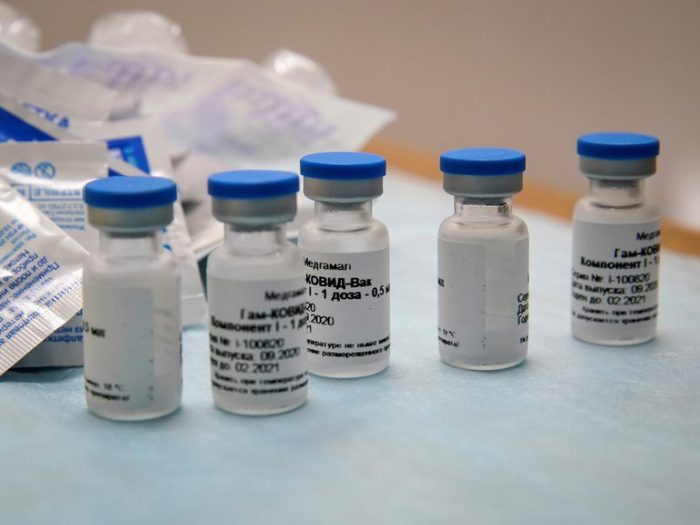
¿Cuántas dosis requiere la vacuna?
Sputnik V debe administrarse en dos inyecciones con 21 días de diferencia (régimen de vacunación de refuerzo).
¿La plataforma para la Sputnik V se ha utilizado anteriormente fuera de Rusia?
La eficacia de la plataforma de vectores adenovirales humanos ha sido ampliamente probada a nivel internacional en vacunas que no son COVID-19, incluso por algunas de las compañías farmacéuticas más importantes del mundo. Más de 250 ensayos clínicos y 75 publicaciones internacionales confirman la seguridad de las vacunas y medicamentos basados en vectores adenovirales humanos.
¿Qué vacunas y medicamentos ha desarrollado anteriormente el Centro de Investigación en Epidemiología y Microbiología Gamaleya?
Antes de la Sputnik V, el Centro de Investigación Gamaleya desarrolló una vacuna contra el virus del Ébola que se utilizó en 2017 para combatir la epidemia de fiebre del Ébola en África, y una vacuna candidata frente al síndrome respiratorio de Oriente Medio (actualmente en ensayo clínico de Fase II). Ambas vacunas se desarrollaron utilizando la plataforma basada en adenovirus humanos de dos vectores. El Centro Gamaleya también ha desarrollado vacunas contra la influenza (vacuna con vector rAd), la tuberculosis (vacuna recombinante), la tos ferina (vacuna viva) (ambas en ensayos clínicos). El Centro de Investigación Gamaleya también produce la vacuna BCG contra la tuberculosis.
¿Cómo de efectiva ha demostrado ser hasta ahora la Sputnik V como protección frente al COVID-19?
Tal y como se publicó en The Lancet, la Sputnik V generó una respuesta inmunitaria humoral y celular estable en el 100% de los participantes en los ensayos clínicos de Fase I-II. La Sputnik V generó una respuesta inmune estable, tanto humoral como celular. El nivel de anticuerpos neutralizantes del virus de los voluntarios vacunados con Sputnik V fue mayor que el nivel de anticuerpos de los pacientes que se habían recuperado de COVID-19.
Se formó inmunidad de células T, con ambos tipos de células CD4+ y CD8+, en todos los voluntarios que han participado en ensayos clínicos de Sputnik V (estas células especiales reconocen y alteran las células infectadas por SARS-CoV-2 y son responsables de inmunidad duradera). Se llevarán a cabo más investigaciones para validar los resultados de la Fase I-II en el estudio de Fase III en curso.
¿Es segura la Sputnik V?
Los ensayos clínicos de Fase I-II de la Sputnik V, publicados en la prestigiosa revista médica, revisada por pares, The Lancet, no han notificado eventos adversos graves o severos (Grado 3). La incidencia de eventos adversos graves para otros candidatos a vacuna COVID-19, ha oscilado hasta la fecha entre el 1% y el 25%. Sputnik V no contiene el virus SARS-CoV-2 en sí, por lo que es imposible contraer COVID-19 como resultado de la vacunación.
¿Cuál es el protocolo de ensayo en Fase III?
Ensayo clínico aleatorizado, de doble ciego (ciego para el sujeto del ensayo y el médico del estudio), controlado con placebo, ensayo multicéntrico en asignación paralela de eficacia, inmunogenicidad y seguridad de la vacuna Gam-COVID-Vac de vector combinado contra la infección inducida por el coronavirus SARS-CoV-2 en adultos en el tratamiento profiláctico de la infección por SARS-СoV-2.
El ensayo incluirá a 40.000 voluntarios mayores de 18 años. Después del cribado, serán distribuidos aleatoriamente (3: 1) en dos grupos: un grupo de referencia de 10.000 voluntarios que recibirán placebo, y un grupo de estudio de 30.000 voluntarios que recibirán la vacuna de vector combinado Gam-COVID-Vac contra la infección inducida por coronavirus SARS-СoV-2. Los sujetos del ensayo se distribuirán aleatoriamente en cinco grupos de edad: 18-30, 31-40, 41-50, 51-60 y 60+ años.
Cada persona participará en el ensayo durante 180±14 días después de la primera dosis del fármaco en estudio/placebo y recibirá una visita de screening y cinco visitas in situ del médico del estudio durante dicho período. El fármaco en estudio/placebo se administrará por vía intramuscular durante las visitas de vacunación 1 y 2 (día 0 y día 21±2). Las visitas 3, 4 y 5 de observación posteriores se realizarán los días 28±2, 42±2 y 180±14 respectivamente. Durante las visitas de observación, se evaluarán los signos vitales en todos los sujetos del ensayo y se registrarán los cambios en el estado y el bienestar de los sujetos en comparación con la visita anterior. Las visitas de observación 3, 4 y 5 pueden ser remotas, a través de una consulta de telemedicina (TMC).
INFORMACIÓN/INFOBAE